
一文读懂新型冠状病毒的抗原/抗体/核酸检测试剂
2020年1月份以来,国家药品监督管理局根据《医疗器械应急审批程序》,已批准多家企业的新型冠状病毒检测试剂盒上市。近日多家企业设计开发了新型冠状病毒抗原/抗体/核酸检测试剂,不同试剂在检验原理、试验方法、预期用途等方面均存在差异,下面对此进行简单介绍。
一、什么是抗原检测试剂?
新型冠状病毒基因编码多个结构蛋白,例如N蛋白、E蛋白和S蛋白等,这些蛋白包括多个抗原表位,利用抗原与抗体特异性结合的原理,可通过抗体检测抗原的存在,从而直接证明样本中含有新型冠状病毒。抗原检测试剂的适用样本类型一般为感染部位样本,例如咽拭子。
二、什么是抗体检测试剂?
新型冠状病毒的上述抗原,可作为免疫原,在病毒感染人体后,刺激浆细胞产生特异性抗体,利用抗原与抗体特异性结合的原理,可通过抗原检测抗体的存在,从而间接证明人体已感染新型冠状病毒。抗体检测试剂的适用样本类型一般为血液,包括血清、血浆和全血。
检测的抗体主要分为IgM和IgG两类。目前对新型冠状病毒的这两类抗体的产生和持续时间尚缺乏系统性研究。通常情况下,IgM抗体产生早,一经感染,快速产生,维持时间短,消失快,血液中检测阳性可作为早期感染的指标。IgG抗体产生晚,维持时间长,消失慢,血液中检测阳性可作为感染和既往感染的指标。
三、抗原/抗体检测试剂运用的方法
抗原/抗体检测试剂均基于抗原与抗体特异性结合的免疫学原理,常用的方法学主要有胶体金法,免疫荧光层析法、酶联免疫法和化学发光法。胶体金法操作便捷,可直接目视判读,一般15分钟即可完成检测;免疫荧光层析法与胶体金法一样操作便捷,检测迅速,但需要仪器判读;酶联免疫法可采用常规酶标仪判读,一般灵敏度较高,但检测时间较长(约1.5小时以上),而且操作步骤较多,操作过程中应采取措施避免感染。化学发光法一般灵敏度亦较高,采用全自动化学发光免疫分析仪,无需过多手工操作即可完成检测,检测时长一般约半小时。
四、抗原/抗体检测试剂的关键
抗原/抗体检测试剂的关键是获得高度灵敏且特异的抗原与抗体用于检测,但是抗体制备工艺繁琐耗时,重组抗原技术相对快速,但是选择最佳抗原亦需要时间和试验依据。另外,由于抗体的产生和消失是一个动态过程,选择合理的采样时机亦非常关键,但是目前尚缺乏相关研究数据。
五、抗原/抗体检测试剂的定位
鉴于抗原/抗体检测试剂的特点与现状,目前其灵敏度和特异性有限,不能作为新冠肺炎确诊和排除的唯一依据,不适用于一般人群的筛查,仅可作为已有病毒核酸检测试剂的补充。
产品预期用途建议限定于对核酸检测阴性疑似病例的补充检测指标,或疑似病例诊断中与核酸检测协同使用。
通过核酸、抗原和抗体多种检测方式联合应用,缩短检测窗口期,提高阳性检出率,在新冠肺炎的辅助诊断方面,具有十分重要的作用。
六、抗原/抗体检测试剂的审评审批
器审中心高度关注新型冠状病毒的抗原/抗体检测试剂,已经研究制定了相关审评要点,用于指导企业对产品的验证确认和注册申报工作。对于疫情防控相关试剂,我中心力争在提高审评效率的同时,保证产品质量,全力服务疫情防控需要。
七、新型冠状病毒的核酸检测原理
所有生物除朊病毒外都含有核酸,核酸包括脱氧核糖核酸(DNA)和核糖核酸(RNA),新型冠状病毒是一种仅含有RNA的病毒,病毒中特异性RNA序列是区分该病毒与其它病原体的标志物。新型冠状病毒出现后,我国科学家在极短的时间里完成了对新型冠状病毒全基因组序列的解析,并通过与其它物种的基因组序列对比,发现了新型冠状病毒中的特异核酸序列。临床实验室检测过程中,如果能在患者样本中检测到新型冠状病毒的特异核酸序列,应提示该患者可能被新型冠状病毒感染。
检测新型冠状病毒特异序列的方法最常见的是荧光定量PCR(聚合酶链式反应)。因PCR反应模板仅为DNA,因此在进行PCR反应前,应将新型冠状病毒核酸(RNA)逆转录为DNA。在PCR反应体系中,包含一对特异性引物以及一个Taqman探针,该探针为一段特异性寡核苷酸序列,两端分别标记了报告荧光基团和淬灭荧光基团。探针完整时,报告基团发射的荧光信号被淬灭基团吸收;如反应体系存在靶序列,PCR反应时探针与模板结合,DNA聚合酶沿模板利用酶的外切酶活性将探针酶切降解,报告基团与淬灭基团分离,发出荧光。每扩增一条DNA链,就有一个荧光分子产生。荧光定量PCR仪能够监测出荧光到达预先设定阈值的循环数(Ct值)与病毒核酸浓度有关,病毒核酸浓度越高, Ct值越小。不同生产企业的产品会依据自身产品的性能确定本产品的阳性判断值。
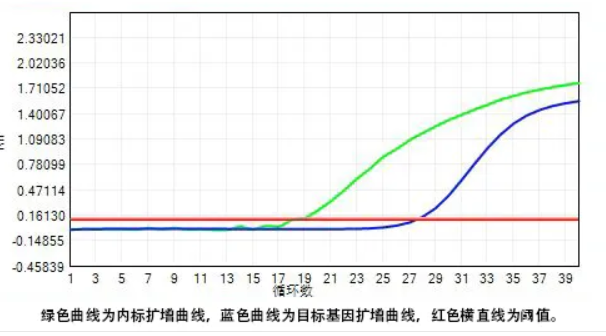
八、新型冠状病毒的核酸检测流程
对于新型冠状病毒的核酸检测,首先根据试剂盒说明书【样本要求】部分进行样本采集,常规的样本类型包括咽拭子、鼻拭子、痰液、支气管灌洗液、肺泡灌洗液等。由于新型冠状病毒为RNA病毒,RNA易降解,因此,采集样本时使用无RNA酶的拭子和无RNA酶的储存管。获得患者样本后,需尽快进行检测,如无法立即检测需要转运的样本,应按照说明书的要求进行低温封装,并送到专门的检测机构进行检测。检测机构收到样本后,对样本进行核酸提取,核酸提取试剂应使用批准产品说明书中指定的核酸提取试剂盒。
(图:咽拭子取样示意图)
病毒RNA需要首先逆转录为cDNA,再进行扩增检测。PCR扩增和检测应使用批准产品说明书中指定的荧光定量PCR仪,通过荧光定量PCR所得到的样本Ct值的大小,可以判断患者样本中是否含有新型冠状病毒。
上述过程中样本的采集、保存、转运,样本核酸的提取和检测、结果的判读均须严格按照试剂盒说明书要求进行。欲直观了解具体的检测过程,可查询相关示范视频,例如北京协和医院录制的示范短片。
九、使用新型冠状病毒核酸检测试剂盒的注意事项
(一)全流程的质量控制
在新型冠状病毒的检测过程中,三个最为关键的要素是人员,实验室和试剂盒。
首先,核酸检测的整个检测流程操作复杂,不同产品因存在不同反应体系及适用机型等因素,操作过程中试验人员应按照各自产品说明书要求进行。
实验室检测往往从样本提取开始,但实际上,要保证样本的检测准确,应从患者样本的采集开始进行质量控制,并对后续各个流程规范操作(如样本的保存、转运等)。有研究表明,不同人员对同一患者的样本进行采集,可能存在不同的检测结果。试剂在保存、运输及使用过程中操作不当均可能影响其检测结果。因此,需要严格按照说明书的规定操作。
其次,新型冠状病毒传播能力强,危险系数高,个人防护应为生物安全三级实验室级别。每个操作人员必须具备专业技能且拥有PCR检验资质。整个操作过程中需防范气溶胶污染对人员的感染风险,并做到准确加样和正确使用试剂和耗材。
最后,为防止病毒扩散,检测新型冠状病毒的实验室必须达到生物安全二级(P2)及以上实验室条件,实验室管理应严格按照PCR基因扩增实验室的管理规范,实验操作必须严格分区,各区域使用的仪器、设备、耗材和工作服必须专用,不得交叉使用,避免污染。
所有检测样本应视为具有传染性物质,实验过程中穿工作服,戴一次性手套并经常替换手套以避免样本间的交叉污染;样本操作、废弃物处理均需符合卫生部《微生物生物医学实验室生物安全通用准则》和《医疗废物管理条例》等相关法规要求。
(二)检测结果判断要求
目前批准产品均基于新型冠状病毒基因组中开放读码框1a/b(open reading frame 1ab,ORF1ab)、包膜蛋白(Envelope protein,E)和核衣壳蛋白(nucleocapsid protein,N)进行选择。不同产品的检测原理基本一致,但是其引物、探针设计存在不同,有单靶区段(ORF1ab)、双靶区段(ORF1ab、N蛋白)、三靶区段(ORF1ab、N蛋白和E蛋白)的检测和判读差别。建议使用者应严格按照不同企业说明书规定的判读方式进行判读。
依据《新型冠状病毒感染的肺炎诊疗方案(试行第五版)》确诊病例要求,临床诊断病例或疑似病例,具备以下病原学证据之一者:
1.呼吸道标本或血液标本实时荧光RT-PCR检测新型冠状病毒核酸为阳性;
2.呼吸道标本或血液标本病毒基因测序,与已知的新型冠状病毒高度同源。
如临床人员对检测结果感觉明显不符。建议对整个检测环节(如:对样本的采集、转动及处理等环节)进行分析。应关注检测结果为阴性的患者,不排除新型冠状病毒早期感染或其他呼吸道病毒感染等。如条件允许,建议采集痰液或肺泡灌洗液等敏感性更高的样本进行复测。
附1.什么是医疗器械应急审批?
当社会存在突发公共卫生事件威胁以及突发公共卫生事件发生时,为有效预防、及时控制和消除突发公共卫生事件危害,确保应急所需医疗器械产品能够尽快完成注册审批程序。
同时,应急医疗器械产品需满足在我国境内尚无同类产品上市,或虽在我国境内已有同类产品上市,但产品供应不能满足突发公共卫生事件应急处理需要的条件。
当应急审批程序启动后,各级药品监督管理部门及相关技术机构,会根据各自职能和程序规定,开展相关医疗器械注册检测、质量管理体系考核、技术审评和行政审批等工作。
附2.医疗器械的应急审批程序是什么?
(一)应急医疗器械的确定程序
首先,医疗器械生产企业应将产品应急所需的情况及产品研发情况事先告知相应的药品监督管理部门。
同时,药品监督管理部门会及时了解相关医疗器械研制情况,必要时将采取早期介入的方式,对拟申报产品进行技术评估。
其次,医疗器械生产企业应向药品监督管理部门先行提交综述资料及相关说明。
再次,药品监督管理部门会设立特别专家组,对申请应急审批的医疗器械产品进行有效评估和审核。
最后,对于确定为应急医疗器械的产品,相关企业应向医疗器械注册部门递交注册资料。相关部门按照应急程序进行审评审批。
(二)医疗器械应急审批程序
首先,确定为应急医疗器械产品的企业需递交注册申报资料,相应医疗器械注册受理部门受理后,将该注册申请项目标记为”应急审批”,并于受理当日由专人负责进行注册申报资料流转。
其次,第二类应急审批医疗器械注册申请受理后,药品监督管理部门应当在5日内完成技术审评;技术审评结束后,在3日内完成行政审批。
同时,第三类应急审批医疗器械注册申请受理后,药品监督管理部门应当在10日内完成技术审评;技术审评结束后,在3日内完成行政审批。
再次,对于应急审批医疗器械,相关医疗器械检测机构应当在接收样品后24小时内组织开展医疗器械注册检测,并及时出具检测报告。
然后,对于应急审批医疗器械,相应的药品监督管理部门在接到生产企业质量管理体系考核申请后,应当在2日内组织开展现场考核工作,并及时出具质量管理体系考核报告。
最后,药品监督管理部门按照统一指挥、早期介入、快速高效、科学审批的原则对应急医疗器械产品进行审评审批,相关企业在审评审批过程中可及时与相关工作人员联系,确保效率。


